类器官概述
Hans Clever 在2009年利用Lgr5+肠道干细胞成功培养出首个小肠类器官,开启了类器官研究的时代。此后,类器官在短短十多年的时间里,在科学研究领域逐渐繁荣起来,成为体外模型系统研究的热点。本文我们将介绍类器官的发展历史、构建与制备、类别和应用。
1、什么是类器官?
顾名思义,类器官和真正的器官非常相似,从专业角度阐释,类器官是体外的3维立体微型细胞簇,高度模拟体内相应器官的结构和功能[1]。通俗来讲就是类器官是一个体外构成的具有自我更新,自我组织能力的微型器官,与真实的器官具有相似的空间组织并且能够执行原始器官功能。
类器官的三个特征:
- ● 细胞能够通过空间组织和细胞特异化自行组织,重现原始器官功能;
- ● 含有一种以上与原始器官相同的细胞[2];
- ● 能够再现原始器官的某些功能,例如:过滤,排泄,神经链接以及收缩功能等。
2、类器官的发展历程
1907年,Henry Van 发现物理分离的海绵细胞可以重现聚集,自行组成一个新的功能完善的海绵[3]。在接下来的几十年里,脊椎动物中也发现了相似的细胞分离再聚合现象,例如1944年Holtfreter的两栖动物肾组织实验[4]和1960年Weiss的禽类胚胎实验[5]。1961年 Piercehe和 Verney观察到胚状体的体外分化[6],随后在1964年 Steinberg提出了细胞分化的差异粘附假说(DAH),1981年多功能干细胞(PSCs)被首次从小鼠的胚胎中分离出来,干细胞研究自此蓬勃发展[7,8]。
1987年李茂林等人通过模拟生物体内微生物环境优化了细胞培养条件。研究表明,EHS (小鼠肉瘤:Engelbreth-Holm-Swarm) ECM(细胞外基质:extracellular matrix)提取物中,乳腺上皮细胞可组织成3D导管和小导管[9],此外,Shannon JM在ECM细胞中发现肺泡Ⅱ型上皮细胞分化[10]。但是直到 1998 年,美国生物学家 James Thomson 才首次从人胚泡中分离培养出人胚胎干细胞[11]。
2006年,通过对小鼠和人成纤维细胞进行重组编程,成功制备了人诱导多能干细胞(iPSCs),这对干细胞和类器官研究有重大意义[12]。2008年,Sasai等人通过展示人类大脑诱导多能干细胞自组织到形成极化皮质组织的神经细胞,奠定了类脑器官的基础[13]。2009年,Hans Clevers和他的同事首次证明了单个Lgr5+肠道干细胞(ASCs)可以自行组织分化形成包含所有肠细胞类型的肠隐窝-绒毛结构.这开启了类器官技术发展的新时代[14]。在此基础上类器官模型成为替代传统细胞系和异质动物模型的新型研究模型。2010年,研究发现小鼠胚胎肾干细胞分离再组合可形成肾类器官[15]。肠类器官可从体外诱导多能干细胞生成。
Nakano等在2012年证明了在三维构建中PSCs自行组织成为了视杯结构。2013年,人类大脑类器官由小头患者的iPSCs细胞分化形成[16]。Lee等人发现内皮细胞和成年细支气管肺泡干细胞在三维共培养模式下可产生肺类器官[17]。乳腺、输卵管和海马类器官是在2015年研究得出的,蛇毒腺类器官产生于2020年[18]。
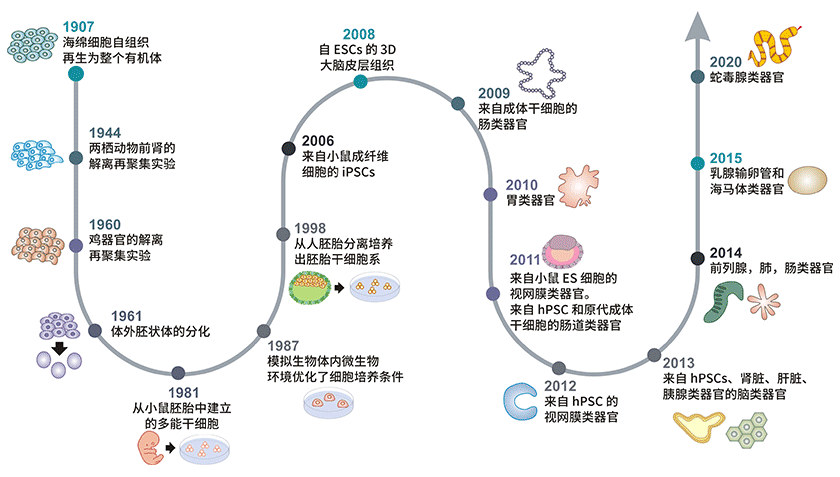
图1. 类器官发展时间线
图片来源:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7468890/
3、类器官的构建与制备
类器官的形成:类器官可以由两种类型细胞产生,一是多能干细胞(PSCs),例如胚胎干细胞(ESCs)、诱导干细胞(iPSCs),或器官限制性成体干细胞(ASCs)。这些细胞被培养在一个特定的环境中,允许它们遵循根深蒂固的基因指令,自x行组织成功能性的3D结构。
从各种组织中培养类器官的方法是相似的。干细胞最常在基质中培养,并在合适的外源因子(包括化学小分子抑制剂/激活剂、细胞因子和培养基添加剂)的存在下诱导形成相应器官的类器官。不同类器官的制备需要不同的添加剂组合。即使是结构非常相似的组织,如小肠和结肠,制备类器官所需的添加剂组合也是不同的。此外,直接从患者的肿瘤中生成类器官也是一种实用的方法。
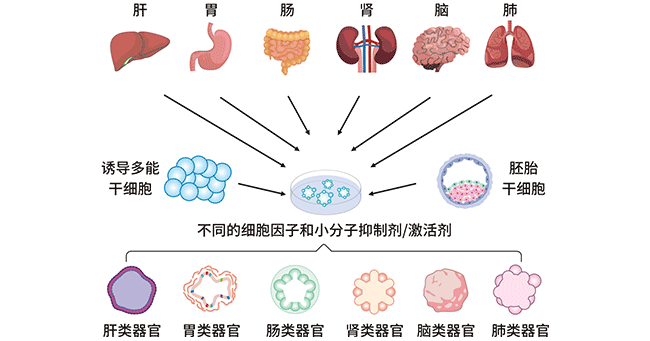
图2. 人类不同类器官的建立过程
图片来源:https://journals.plos.org/plospathogens/article?id=10.1371/journal.ppat.1010080
类器官构建的三要素:
- ● 细胞分化物理特征
- ● 关键信号路径的激活/抑制
- ● 原始细胞的类型及条件
4、类器官的类别及应用
自2009年成功建立上皮类器官以来,类器官培养已应用于各种器官,包括:大脑(brain)、视杯(Optic Cup)、内耳(Inner Ear)、肺(lung)、肝(liver)、结肠(Colon)、肾(Kidney)、胰腺(Pancreatic)、前列腺(Prostate)、胃(Gastroids)、乳腺(galactophore)等。
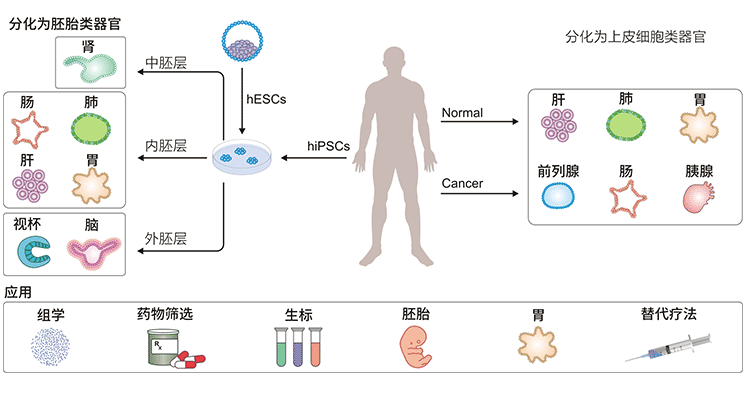
图3. 类器官及应用
图片来源:https://doi.org/10.1016/j.cell.2016.05.043
Jay Gopalakrishnan 的团队成功地在大脑类器官中诱导出双边对称的视杯,并发现这种结构可以感知光,同时向其他区域的大脑发送信号。当这些类器官生长50-60天后,原来的“眼睛”发育成一两个成熟的可见视泡结构,称为视泡脑类器官(OVB-organoids)。这项研究首先在功能上将视网膜结构整合到大脑类器官中,在体外系统中再现神经纤维从视网膜神经节向外延伸以连接大脑的目标区域。该系统可以帮助研究胚胎发育过程中的“脑-眼”相互作用,为视网膜疾病的探索和治疗提供有力的工具,为无数视网膜疾病患者的治愈带来希望。
现在,科学家已经开发了更精确的合成环境,通过用信号蛋白修饰基质的生物惰性区域,可以更好地控制干细胞的活性。类器官工程技术对于一些体内环境成分复杂、需要精确建模的发育研究特别有用。通过多能干细胞构建的类器官还可以取代受损或者患病的组织,类器官本身自我更新自我组织的这一功能在再生医学领域也有重要作用。
研究人员可以通过类器官来模拟人类发育和疾病,因为类器官是从人类干细胞或成年细胞产生的诱导性多能干细胞生长而来的,它们的成分和结构也与原发组织相似,并且易于操作和冷冻保存。利用活检技术就可以培养与病人具有遗传相似性的类器官模型,同时意味着可以利用源自患者干细胞的类器官系统来进行个性化药物功效测试,为患者提供更加精准的治疗方法。
虽然类器官技术在研究界的广泛应用还处于起步阶段,但作为研究发育生物学、疾病病理学、细胞生物学、再生机制、精准医疗、药物毒性和药效实验等广泛学科的工具,类器官技术具有巨大的应用潜力。
参考文献:
[1] Clevers, H. Modeling Development and Disease with Organoids [J]. Cell 2016, 165, 1586–1597.
[2] Stevens KR, Kreutziger KL, Dupras SK et al. (2009) Physiological function and transplantation of scaffold-free and vascularized human cardiac muscle tissue [J]. Proc Natl Acad Sci 106:16568–16573.
[3] Wilson HV. A new method by which sponges may be artificially reared [J]. Science 25: 912–915, 1907.
[4] Holtfreter, Johannes. Experimental studies on the development of the pronephros [J]. Rev. can. biol. 3 (1943): 220-250.
[5] Weiss, Paul, and A. C. Taylor. Reconstitution of complete organs from single-cell suspensions of chick embryos in advanced stages of differentiation [J]. Proceedings of the National Academy of Sciences of the United States of America 46.9 (1960): 1177.
[6] Pierce, G. B., Jr. & Verney, E. L. (1961). An in vitro and in vivo study of differentiation in teratocarcinomas [J]. Cancer 14, 1017-1029.
[7] Martin GR. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells [J]. Proc Natl Acad Sci USA 78: 7634–7638, 1981.
[8] Evans M. J., Kaufman M. H. 1981. Establishment in culture of pluripotential cells from mouse embryos [J]. Nature 292, 154–156.
[9] Li ML, Aggeler J, Farson DA, et al. Influence of a reconstituted basement membrane and its components on casein gene expression and secretion in mouse mammary epithelial cells [J]. Proc Natl Acad Sci USA 84: 136–140, 1987.
[10] Shannon JM, Mason RJ, Jennings SD. Functional differentiation of alveolar type II epithelial cells in vitro: effects of cell shape, cell-matrix interactions and cell-cell interactions [J]. Biochim Biophys Acta 931: 143–156, 1987.
[11] Thomson JA, Itskovitz-Eldor J, et al. Embryonic stem cell lines derived from human blastocysts [J]. Science 282: 1145–1147, 1998.
[12] Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors [J]. Cell 126: 663–676, 2006.
[13] Eiraku, Mototsugu, et al. Self-organized formation of polarized cortical tissues from ESCs and its active manipulation by extrinsic signals [J]. Cell stem cell 3.5 (2008): 519-532.
[14] Hans Clevers, Sato T, Vries RG, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche [J]. Nature 459: 262–265, 2009.
[15] Unbekandt, Mathieu, and Jamie A. Davies. Dissociation of embryonic kidneys followed by reaggregation allows the formation of renal tissues [J]. Kidney international 77.5 (2010): 407-416.
[16] Lancaster, Madeline A., et al. Cerebral organoids model human brain development and microcephaly [J]. Nature 501.7467 (2013): 373-379.
[17] Lee, Joo-Hyeon, et al. Lung stem cell differentiation in mice directed by endothelial cells via a BMP4-NFATc1-thrombospondin-1 axis [J]. Cell 156.3 (2014): 440-455.
[18] Clevers, H. Modeling Development and Disease with Organoids [J]. Cell 2016, 165, 1586–1597.






